Регулятор предположил, когда "Спутник V" могут одобрить в ЕС
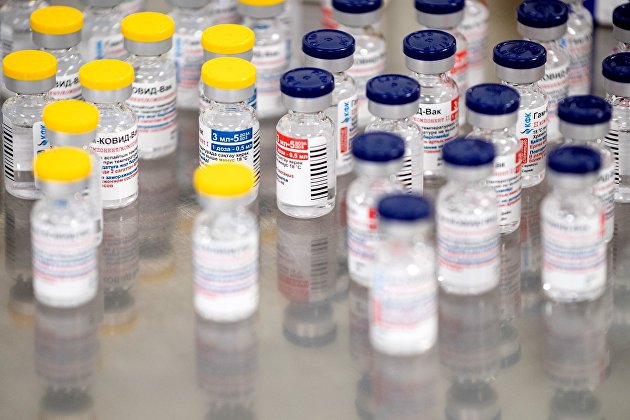
" Производство вакцины Sputnik V
© Sputnik / Перейти в фотобанк
БРЮССЕЛЬ, 26 фев — ПРАЙМ. Европейское агентство по лекарственным средствам ЕМА пояснило РИА Новости, что процедура одобрения новых вакцин и лекарств против коронавируса была серьезно ускорена с началом пандемии, но все равно занимает несколько месяцев, поскольку необходимо удостовериться в эффективности и безопасности появляющихся препаратов. 
Египет зарегистрировал российскую вакцину "Спутник V"
Ранее сообщалось, что разработчик российской вакцины от коронавируса "Спутник V" ведет переговоры с европейским лекарственным регулятором ЕМА для регистрации вакцины на рынке Евросоюза (получения регистрационного удостоверения).
Вопрос ускорения регистрации новых вакцин обсуждался в пятницу на специальной видеоконференции глав государств и правительств Евросоюза. Европейские лидеры решили по итогам переговоров, что необходимо "срочно ускорить авторизацию, производство и распространение вакцин".
В настоящее время даже ускоренная процедура авторизации медицинских препаратов занимает не один месяц и связана с подробнейшими исследованиями как эффективности, так и возможных побочных негативных эффектов препарата. "Процессы исследования и аттестации лекарственных средств в ЕС являются надежными процедурами и основываются на высоких стандартах качества, эффективности и безопасности", — сказал представитель ЕМА.
Стандартная продолжительность процедуры оценки регулятором ЕС лекарственных препаратов составляет порядка 210 рабочих дней. При этом допускаются два перерыва сроком от одного до шести месяцев, во время которых ЕМА направляет разработчику вопросы или запросы дополнительной информации. В итоге авторизация нового препарата на рынке ЕС может длиться год. Благодаря ускоренной процедуре изучение препаратов против коронавируса было сокращено до 150 рабочих дней. Но скорость принятия решения ЕМА напрямую зависит от данных, представленных разработчиком, а также от того, насколько быстро он будет реагировать на дополнительные вопросы регулятора.
Европейский регулятор также может использовать специальную процедуру постепенной экспертизы (rolling review) для ускоренной оценки перспективных препаратов. Это позволяет EMA оценивать данные по препарату по мере их поступления еще в ходе процесса его разработки и дополнительно сократить период рассмотрения заявок. 
В Австрии сравнили вакцину "Спутник V" с автоматом Калашникова
К примеру, 15 февраля официальную заявку на авторизацию своей вакцины против коронавируса в ЕС подала компания Johnson&Johnson. По расчетам европейского регулятора, эта заявка может быть одобрена уже в середине марта. При этом ЕМА сообщала, что вела процедуру постепенной экспертизы препарата J&J с 1 декабря прошлого года, и европейские специалисты все это время наблюдали за этапами разработки вакцины. Кроме того, еще до подачи официальной заявки для выхода на общеевропейский рынок производитель вакцины может обратиться к европейскому регулятору за так называемой "научной консультацией" (scientific advice).
"В ходе создания препарата разработчик может запросить у EMA руководство по самым приемлемым для ЕС методикам и форме для презентации препарата, его эффективности и безопасности", — говорится в документах ЕМА. Таким образом европейский регулятор пытается максимально сократить срок подачи и рассмотрения заявки, указав соискателю на то, какие данные и в какой форме лучше собрать и представить для оценки ЕМА.
"При этом научная консультация не является предварительной оценкой преимуществ и рисков препарата, а также не гарантирует, что препарат получит маркетинговое разрешение", — указывают в ЕМА. 
Врачи сравнили российские вакцины от коронавируса
В начале февраля в ЕМА сообщили, что разработчик российской вакцины "Спутник V" уже благополучно прошел научную консультацию и может готовить заявку для получения разрешения на реализацию препарата в ЕС. На данный момент ЕМА не подтверждала, что начала процесс постепенной экспертизы "Спутник V" или что разработчик подал заявку на регистрацию.
При подаче заявки на маркетинговое разрешение разработчик представляет в ЕМА всю информацию, собранную в ходе разработки, испытаний и производства препарата. Агентство затем оценивает эту информацию и определяет, является ли препарат безопасным и можно ли его рекомендовать для использования в ЕС. Главный принцип оценки препарата ЕМА – это баланс между его преимуществами и рисками. Агентство проводит с разработчиком консультации, в которых принимают участие специалисты агентства в разных областях. Это должно гарантировать качество заявки, соответствие предоставленных в ней данных европейским требованиям.
ЕМА отмечает, что тщательно отбирает экспертов для участия в различных этапах оценки препарата, чтобы гарантировать их беспристрастность. Европейское агентство по лекарственным средствам гарантирует, что научные эксперты, которые занимаются оценкой препаратов, не имеют каких-либо финансовых или иных интересов, которые могли бы повлиять на их беспристрастность.
В оценке участвует комитет экспертов (научный комитет ЕМА по медицинским препаратам для человека CHMP). Он изучает все поданные заявки и затем голосует по вопросу предоставления регистрационного удостоверения. В комитет входят представители национальных регуляторов от всех стран-членов ЕС, а также Исландии и Норвегии. Каждый член комитета имеет свою команду ассистентов. В CHMP также могут входить до пяти европейских экспертов в определенных узких областях (как, например, статистика, контроль качества), назначаемые Еврокомиссией. Для каждой заявки по новому препарату комитет CHMP ЕМА назначает докладчика и содокладчика (или только докладчика), которые ведут процесс оценки препарата. Они проводят научную оценку поданных в заявке данных независимо друг от друга, готовят свои отчеты и формулируют вопросы к разработчику. Докладчики также могут рекомендовать проведение инспекции предприятия, где производится препарат. В инспекции могут принимать участие представители европейских национальных агентств по лекарственным препаратам. 
"Спутник V" может помочь повысить эффективность вакцин Moderna и Pfizer
По итогам многоэтапного рассмотрения заявки комитет CHMP на своем пленарном заседании проводит голосование за одобрение или отклонение заявки разработчика препарата на получение регистрационного удостоверения. При этом в ЕМА подчеркивают, что практически в 90% случаев удается достичь единогласного решения комитета.
В условиях пандемии EMA может рекомендовать выдачу временного или условного маркетингового разрешения. Такое разрешение предусмотрено к выдаче в экстренных случаях, когда существует угроза общественному здоровью на уровне ЕС.
Если заявка поддержана, то ЕМА рекомендует ее Еврокомиссии, которая принимает окончательное решение по выводу того или итого препарата на рынок ЕС. Дальнейшие решения, к примеру, о цене препарата, принимаются в ходе переговоров с производителем на национальном уровне, если речь не идет о централизованных закупках препарата Еврокомиссией.
В ЕМА также отмечают, что и после выдачи регистрационного удостоверения продолжается мониторинг применения препарата, проводится оценка его побочных эффектов, могут вноситься правки и дополнения в удостоверение или же в информацию о препарате и его применении.
В настоящее время на рынке Евросоюза авторизованы три вакцины: компаний Pfizer/BioNTech (закупка до 600 миллионов доз), Moderna (два контракта до 460 миллионов доз) и AstraZeneca (до 400 миллионов доз). Кроме того, ЕК заключила контракты на поставки в ЕС вакцин с компаниями Johnson&Johnson, Sanofi-GSK, CureVac. До настоящего момента Sanofi-GSK и CureVac еще не подали заявки для авторизации своих препаратов на рынке ЕС, J&J подала заявку на авторизацию 16 февраля. CureVac, в свою очередь, 12 февраля сделала запрос на проведение процедуры постепенной экспертизы rolling review. Всего страны ЕС благодаря контрактам Еврокомиссии смогут получить доступ более чем к 2,3 миллиарда доз антикоронавирусных вакцин. В ЕС ожидают, что к середине сентября в Европе уже будут привиты порядка 70% жителей.
В последние недели ЕС столкнулся с рядом проблем в поставках одобренных для использования в союзе вакцин компаний Pfizer/BioNTech и AstraZeneca. Задержки в поставках могут сорвать амбициозные планы Брюсселя по вакцинации.
Читайте также:
Россия ведёт переговоры с компаниями Австрии о производстве "Спутник V"
https://1prime.ru/business/20210226/833119483.html






